Saphenion®: Nebenwirkungen beim Venenkleber – Hintergründe:
Saphenion®: Nebenwirkungen beim Venenkleber – Intensiv wird auf Kongressen und Webseminaren, aber auch in internationalen und nationalen Fachartikeln über mögliche Nebenwirkungen der „neuen“ (14 Jahre alten) Therapieoption „Venenkleber“ beim Einsatz an Stammkrampfadern diskutiert.
Besonders intensiv ist diese Diskussion in Deutschland. Haben wir doch hier ein duales ambulantes / stationäres Gesundheitssystem mit unterschiedlichen Vergütungsstrukturen. Aus diesem Grund spielt die Auswahl abrechnungsrelevanter Therapieoptionen eine sehr große Rolle. Die Vielfalt der Therapiemöglichkeiten für Krampfadern vom klassischen radikalchirurgischen Herausziehen (Stripping) von Stamm – und Seitenastkrampfadern über kathetergestützte thermische Verfahren (Laser, Radiowelle, Heißdampf) bis hin zu nicht thermischen Verfahren (Mikroschaum, Clarivein, Venenkleber) erfordert eine umso umfassendere Aufklärung des Patienten.
Der Patient sollte idealerweise in die Lage versetzt werden, die für ihn angenehmste Methode selbst wählen zu können. Dabei spielen vielfältige Auswahlkriterien eine grosse Rolle. Dies kann aber nur gewährleistet werden, wenn wirklich umfassend und in alle Richtungen aufgeklärt wird. Leider aber ist die Realität hier wirklich anders und wird auch durch einseitige und sachlich unvollständige oder falsche wissenschaftliche Artikel verzerrt.
Saphenion®: Nebenwirkungen beim Venenkleber? Der Autor hat im Rahmen seiner in 1988 begonnenden Tätigkeit als Chirurg und Gefäßchirurg alle gängigen Therapiemethoden eingesetzt und kann sich ein wenig auf eigene Erfahrungen verlassen. Der Venenkleber „VenaSeal“ ist bei Saphenion® seit 2012 an 4716 Stammkrampfadern bei 2243 Patienten eingesetzt worden. Die daraus abgeleiteten Erfahrungen werden den wissenschaftlichen Kommentaren in dieser News gegenüber gestellt.
Saphenion®: Side effects of vein glue – background information:
Saphenion: Side Effects of Vein Glue – There is an intensive discussion at congresses and web seminars, as well as in international and national specialist articles, about possible side effects of the „new“ (14-year-old) treatment option, „vein glue,“ when used on truncal varicose veins.
This discussion is particularly intense in Germany. After all, we have a dual outpatient/inpatient healthcare system with different reimbursement structures. For this reason, selecting billing-relevant treatment options plays a vital role. The variety of treatment options for varicose veins, ranging from classic radical surgical removal (stripping) of truncal and side branch varicose veins to catheter-based thermal procedures (laser, radiofrequency, and superheated steam) and non-thermal procedures (microfoam, Clarivein, and vein glue), requires even more comprehensive information for patients.
Ideally, the patient should be able to choose the method that is most comfortable for them. A variety of selection criteria play a major role here. However, this can only be guaranteed if the information is comprehensive and covers all aspects. Unfortunately, however, the reality here is different and distorted by one-sided and factually incomplete or incorrect scientific articles.
Saphenion®: Side effects of vein glue? The author has employed all common treatment methods throughout his career as a surgeon and vascular surgeon, which began in 1988, and can rely to some extent on his own experience. The „VenaSeal“ vein glue has been used at Saphenion® on 4716 truncal varicose veins in 2243 patients since 2012. The resulting experiences are compared with the scientific comments in this news item.


Saphenion®: Nebenwirkungen beim Venenkleber – Wissenschaftliche Diskussion:
Zitate aus:
Hirsch, Tobias: Vortrag auf den 27. Bonner Venentagen am 30.4.- 01.05.2021.
Hirsch, Tobias: Nebenwirkungen nach nicht-thermischer endovenöser Therapie; vasomed 2021; 33(2): 46-47
- Seit 2011 wird auch N-Butyl-Cyanoacrylat zur Behandlung der Stammvarikose verwendet, für das verschiedene Derivate und verschiedene Applikationsgeräte zur Verfügung stehen (in Deutschland zugelassen: VenaSealTM, Medtronic, USA). Bei dem Verfahren erfolgt der Verschluss der Stammvene, indem über einen Applikationskatheter aller 3 cm ein Bolus (0,09 ml) des viskösen Acrylatmonomers appliziert wird. In der VeClose-Studie (RCT) wurden Fünf-Jahres-Verschlussraten von 91,4 % ermittelt. Beim polymerisierten Akrylat handelt es sich prinzipiell um ein Implantat, welches ähnlich einem Stent, Nahtmaterial oder einer Klammer eingekapselt und endothelialisiert wird. Der metabolische Abbau des Materials findet sehr langsam statt.
- Vereinzelte Fälle von passageren entzündlichen Begleitreaktionen und auch eosinophiler Vaskulitis wurden publiziert, wobei entzündliche Prozesse auch eine Rolle bei der Obliteration der Gefäße spielen. Thrombophlebitiden sind bekanntermaßen bei allen Verfahren zur Stammvenenbehandlung zu beobachten. Dies gilt für Stripping und Phlebektomie ebenso wie für thermische und nicht-thermische endoluminale Verfahren und hat seine Ursache in den verbliebenen Seitenästen. Die nach der Akrylatverklebung bisweilen beobachtbare dolente oder juckende, lokale Rötung ist nicht einer Thrombophlebitis im engeren Sinne zuzuordnen, sondern einer Hypersensitivitätsreaktion mit Mastzell-Degranulation und Eosinophilie. Dieser passagere Reizzustand ist bei bis zu jedem fünften Patienten in der postoperativen Phase zu beobachten und wird auch in allen bislang vorliegenden Untersuchungen beschrieben.
- Neben dieser Lokalreaktion, die sich durch eine strikt intrafasziale Anwendung vermeiden lässt, kann eine systemische Reaktion mit Urtikaria und Juckreiz auch am Stamm auftreten. In diesen Fällen kann eine Behandlung mit Antihistaminika oder Steroiden erforderlich werden.
- Während das polymerisierte Cyanoacrylat innerhalb der behandelten Vene als inertes Implantat reizlos verbleibt bzw. langsam resorbiert wird, kann das Material im extravasalen Umgebungsgewebe zu einer immunologischen Reaktion mit Ausbildung eines Fremdkörpergranuloms führen.
- Seit der Einführung der Methode wurden einzeln Fallberichte veröffentlicht, bei denen diese Fremdkörpergranulome oder auch das gesamte behandelte Gefäß wegen heftiger immunologischer Reaktionen entfernt werden mussten. Analog zur EHIT der thermischen Verfahren wird in seltenen Fällen auch eine „endovenous glue-induced thrombosis“ beschrieben.
- Bei der Akrylat-Embolisation ist die extravasale Applikation des Klebers zu vermeiden. Patienten mit immunologischen Vorerkrankungen sind ebenso ungeeignet für die Methode wie Patienten mit anamnestisch bekannten allergischen Reaktionen auf Akrylate.
Saphenion®: Side effects of vein glue – Scientific discussion:
Quotes from:
Hirsch, Tobias: Lecture at the 27th Bonn Vein Days on April 30 – May 1, 2021.
Hirsch, Tobias: Side effects after non-thermal endovenous therapy; vasomed 2021; 33(2): 46-47
- Since 2011, N-butyl cyanoacrylate has also been used to treat truncal varicosis, for which various derivatives and different application devices are available (approved in Germany: VenaSealTM, Medtronic, USA). In this procedure, the truncal vein is closed by applying a bolus (0.09 ml) of the viscous acrylate monomer every 3 cm via an application catheter. In the VeClose study (RCT), five-year closure rates of 91.4 % were determined. Polymerized acrylate is an implant that is encapsulated and endothelialized, similar to a stent, suture, or staple. Metabolic degradation of the material takes place very slowly.
- Occasional cases of passenger concomitant inflammatory reactions and also eosinophilic vasculitis have been published, whereby inflammatory processes also play a role in the obliteration of the vessels. Thrombophlebitis is known to occur in all truncal vein treatment procedures. This applies to stripping and phlebectomy as well as to thermal and non-thermal endoluminal procedures and is caused by the remaining side branches. The dolent or itchy local redness that is sometimes observed after acrylic bonding is not thrombophlebitis in the narrower sense, but a hypersensitivity reaction with mast cell degranulation and eosinophilia. This passage irritation is present in up to one in five patients.
- In addition to this local reaction, which can be avoided by strict interfacial application, a systemic reaction with urticaria and itching can also occur on the trunk. In these cases, treatment with antihistamines or steroids may be necessary.
- While the polymerized cyanoacrylate remains within the treated vein as an inert implant without irritation or is slowly absorbed, the material can lead to an immunological reaction with the formation of a foreign body granuloma in the surrounding extravascular tissue.
- Since the introduction of the method, individual case reports have been published in which these foreign body granulomas or even the entire treated vessel had to be removed due to severe immunological reactions. Analogous to the EHIT of thermal procedures, „endovenous glue-induced thrombosis“ has also been described in rare cases.
- With acrylate embolization, extravascular application of the glue should be avoided. Patients with pre-existing immunological conditions are also unsuitable for the method, as are patients with a history of allergic reactions to acrylates.

Saphenion®: Nebenwirkungen beim Venenkleber – Unsere Erfahrungen an 4716 therapierten Venen bei 2243 Patienten
Saphenion®: Nebenwirkungen beim Venenkleber?
- Die Behandlung mit Cyanoacrylaten: Seit 1949 sind die chemischen Komponenten des Bioklebers bekannt, der erste Einsatz in der operativen Medizin ist Anfang der 60er Jahre beschrieben.Zunächst wurde der Gewebekleber als Nahtersatz in der Wundversorgung eingesetzt. Nahezu alle operativen Disziplinen haben Cyanoacrylate nunmehr bereits eingesetzt, z.B. die Hautmedizin, die Augenheilkunde, Orthopädie, Chirurgie / Gefäßchirurgie, Neuroradiologie und Kieferorthopädie, Das Risiko einer allergischen Reaktion ist im bisherigen Einsatz in anderen Fachdisziplinen nicht wirklich real – wir haben bisher vier Publikationen oder wissenschaftliche Studien mit Nachweis einer Kontaktallergie in medline or pubmed gefunden. Die FDA – Zulassung der amerikanischen Gesundheitsbehörde aus 2/2015 stellte fest: VenaSeal® is bio-compatibel und biologisch abbaubar, nicht plazentagängig, nicht krebserregend und nicht allergen! Sowohl in unserer eigenen 8-Jahres – Studie, als auch in der Deutschen VenaSeal-Multicenter-Studie, beide in 2020 veröffentlicht, wurden Verschlußraten von 93,3 – 96,1% über 8 Jahre angegeben. Allergien fanden sich nicht, der Kleber wurde in einem Zeitraum von 10-24 Monaten abgebaut. Insofern ist auch nicht von einem Implantat zu sprechen. Das Wort Implantat allein schon jagt einem interessierten Patienten einige Angst ein
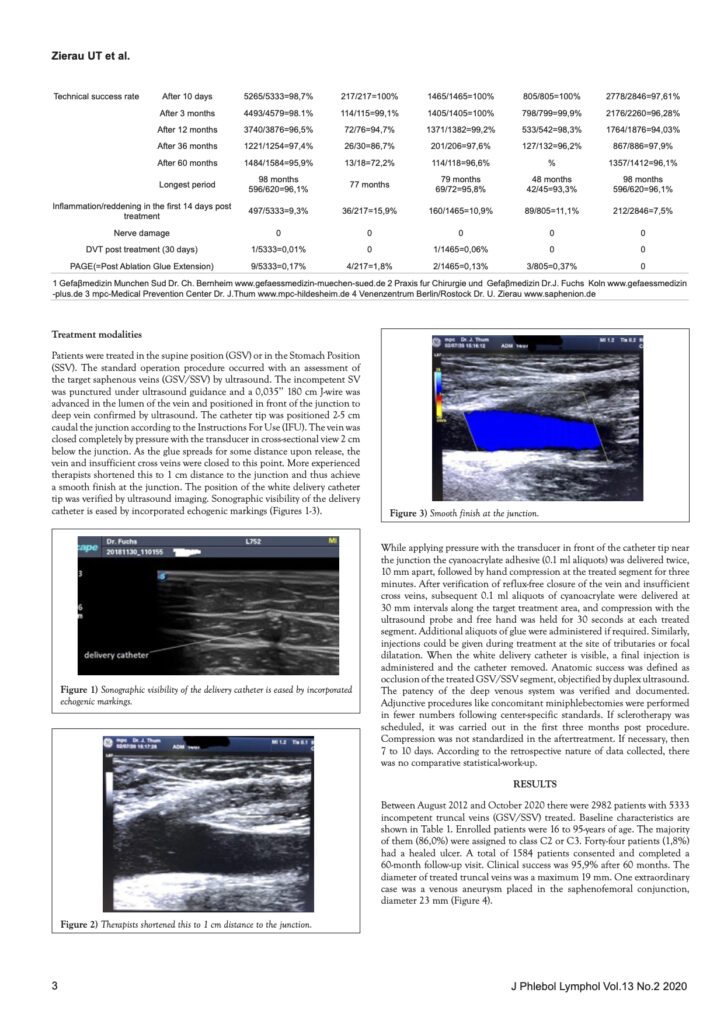
- Entzündliche Reaktionen entlang der Vene (Roter Streifen) fanden sich bei Saphenion® in 7,1% bei Patienten ohne Sauerstoff-Mehrschritt-Therapie und bei 3,9% aller therapierten Venen nach Begleittherapie mit Sauerstoff-Mehrschritt-Therapie und Vakuum-Kompression. In der deutschen Multicenterstudie lagen die Entzündungszeichen zwischen 7,5 – 16%. Behandlungsbedürftige Venenentzündungen (Oberflächliche Venenthrombosen= OVT), auch in Seitenastkrampfadern, fanden sich bisher nicht.
- Es wurde bei Saphenion® auch in keinem Fall eine Therapie mit antiallergischen Medikamenten durchgeführt, eine alleinige Therapie mit Alkoholverbänden, bereits intraoperativ begonnen, half bei der Behandlung von Venenrötungen. Juckreiz und Nesselsucht am ganzen Körper wurden ebenfalls nicht gesehen. Eine strikte Anwendung des Venenklebers „VenaSeal®“ nur innerhalb der Venenfaszie ist nicht nur nicht sinnvoll, sondern auch anatomisch und im Sinne der leitlinienkonformen Therapie von Stammkrampfadern nicht angeraten. Zum Einen verlaufen Stammkrampfadern in ca. 25% aller Fälle auch außerhalb der eigentlichen Venenfaszie, zum Anderen können Stammkrampfadern in ebenso vielen Fällen auch innerhalb der Faszie direkt unter der Haut verlaufen und so eine Rötung als Zeichen des normalen Abbaus des Klebers auf der Haut sichtbar werden. Eine spezielle Aufklärung des Patienten auf diese kurzzeitig sichtbare Hautrötung ist angeraten.
- Bei insgesamt bisher therapierten 2243 Patienten fanden sich in 5 Fällen Fremdkörpergranulome an den Punktionsstellen oder in Venenverlauf (0,12%). Wir haben in allen 5 Fällen nach Auftreten zwischen dem 10. – 14. Monat die Granulome minimalinvasiv komplett entfernt und pathologisch und histologisch untersuchen lassen. In allen 5 Fällen fanden sich keine Kleberreste oder Fremdkörperreste mehr.
- In unserem Patientenkollektiv fanden sich bisher keinerlei Venenkleber – induzierte Thrombosen in den tiefen Bein – und Beckenvenen, auch musste in keinem einzigen Fall eine behandelte und verklebte Stammvene entfernt werden. Solcherart Einzelfallkomplikation ist uns bei 4716 behandelten Venen nicht vorgekommen, noch wurde diese in anderen Einrichtungen durchgeführt. Offen gestanden sind wir sehr erstaunt darüber, dass eine verklebte Stammkrampfader nach 5 Jahren noch entfernt wird. Nach dieser langen Zeit ist die Vene nicht mehr darstellbar. Möglicherweise handelte es sich hier um den Einsatz eines anderen Klebers (VenaBlock®, Türkei)?
- Eine Injektion des Klebers ausserhalb der Vene ist nicht wünschenswert und lässt sich bei entsprechender Sorgfalt und ultraschallgestützter Messung und Kontolle von Gewebetiefe und Katheterlage auch vermeiden. Sollte dies – insbesondere bei Neueinführung des Venenklebers in die eigene Arbeit – dennoch geschehen, kommt es zur Ausbildung einer Gewebefistel zur Haut, daraus entleert sich Gewebeflüssigkeit. Diese Fistel ist minimalchirurgisch sehr gut entfernbar.
- Für die Therapie von Stammkrampfadern gibt es nur in seltenen Fällen fachliche oder klinische Einschränkungen. Dies betrifft in erster Linie die Durchmesser der defekten Stammvenen. Ab einem Venendurchmesser von > 2,0 cm sollten Modifikationen der Therapietechnik vorgenommen werden. Im Gegensatz zu den o.g. Aussagen im Fachvortrag steht der Kleber auch bei Patienten mit Nebenerkrankungen oder komplizierten lokalen Befunden für eine effektive Therapie zur Verfügung. Bei Saphenion® behandelten wir in 78 Fällen simultan auch ein Ulcus cruris – dieses heilte zwischen 2 und 16 Wochen komplett ab. Wir behandelten auch Patienten mit HIV, Parkinson, Covid-19 (5 Patienten), Multiallergien oder Hepatitis ohne klinische Nachwirkungen.
Saphenion®: Side effects of vein glue – Our experience with 4716 treated veins in 2243 patients
Saphenion®: Side effects of vein glue?
- Treatment with cyanoacrylates: The chemical components of the bioadhesive have been known since 1949, and its first use in surgical medicine was described in the early 1960s, initially as a suture substitute in wound care. Almost all surgical disciplines have now used cyanoacrylates, e.g., dermatology, ophthalmology, orthopedics, surgery / vascular surgery, neuroradiology, and orthodontics. The risk of an allergic reaction is not real in other specialist disciplines – we have so far found four publications or scientific studies with evidence of a contact allergy in Medline or PubMed. The FDA approval of the American health authority from 2/2015 stated that VenaSeal® is bio-compatible and biodegradable, not placental, not carcinogenic, and not allergenic! In our 8-year study, as well as in the German VenaSeal Multicenter Study, both published in 2020, closure rates of 93.3 – 96.1% over 8 years were reported. No allergies were found, and the adhesive was degraded over 10-24 months. In this respect, there is no need to speak of an implant. The word implant alone is enough to frighten an interested patient
- Inflammatory reactions along the vein (red stripe) were found with Saphenion® in 7.1% of patients without oxygen multi-step therapy and in 3.7% of all patients with post-operative oxygen multi-step therapy and vacuum-compression. In the German multicenter study, inflammatory reactions were between 7.5 and 16%. There have been no cases of phlebitis requiring treatment (superficial vein thrombosis = OVT), including in side branch varicose veins.
- Saphenion® was also not treated with anti-allergic medication in any case; treatment with alcohol dressings alone started intraoperatively and helped in the treatment of venous redness. Itching and hives all over the body were also not seen. Strict application of the vein adhesive „VenaSeal®“ only within the venous fascia is not only not sensitive but also not recommended anatomically and in terms of guideline-compliant treatment of truncal varicose veins. On the one hand, in approx. In 25% of all cases, varicose veins also run outside the actual venous fascia, and on the other hand, in just as many cases, varicose veins can also run inside the fascia directly under the skin, making redness visible on the skin as a sign of the normal breakdown of the glue. It is advisable to specifically inform the patient about this briefly visible reddening of the skin.
- In a total of 2243 patients treated to date, foreign body granulomas were found at the puncture sites or in the course of the vein in 5 cases (0.13%). In all 5 cases, we completely removed the granulomas in a minimally invasive procedure between the 10th and 14th months after their occurrence and had them examined pathologically and histologically. In all 5 cases, no adhesive residues or foreign body residues were found.
- In our patient group, no vein glue-induced thromboses have been found in the deep leg and pelvic veins, nor has a treated and glued truncal vein had to be removed in a single case. We have not encountered such an isolated complication in 4716 treated veins, nor has it been performed in other facilities. Frankly, we are very surprised that an adhered truncal varicose vein is still being removed after 5 years. After this long time, the vein can no longer be visualized. Could this be due to the use of a different glue (VenaBlock®, Turkey)?
- Injecting the glue outside the vein is not desirable and can be avoided with appropriate care and ultrasound-assisted measurement and control of tissue depth and catheter position. Should this nevertheless happen, especially when the vein glue is newly inserted into the patient’s work, a tissue fistula to the skin will form, from which tissue fluid will drain. This fistula can be removed very easily with minimal surgery.
- Only in rare cases are there any technical or clinical restrictions for the treatment of truncal varicose veins. This primarily concerns the diameter of the defective truncal veins. From a vein diameter of > 2.0 cm, modifications should be made to the treatment technique. In contrast to the above statements in the specialist contract, the adhesive is also available for effective therapy in patients with secondary diseases or complicated local findings. With Saphenion®, we also treated a leg ulcer simultaneously in 78 cases – these healed completely between 2 and 16 weeks. We also treated patients with HIV, Parkinson’s disease, COVID-19 (5 patients), multiple allergies, or hepatitis without any clinical after-effects.
Saphenion®: Nebenwirkungen beim Venenkleber – Unsere Meinung:
VenaSeal® ist eine der endovenösen Techniken mit einer hohen Effektivität, die Qualitätsstandards sind ähnlich denen anderer Behandlungsoptionen. Der VenaSeal® – Venenkleber ist sicher in der Therapie in der Behandlung aller Stammvenen, Seitenäste und Perforanzvenen bis zu einem Durchmesser von 1,5 – 2,0 cm. Größere Durchmesser sind möglich, erfordern aber ein modifiziertes Therapieschema. Wir empfehlen das Venenkleben auch bei ektatischen Venen (über 1.5 cm), Aneurysmata und post entzündlichen Stammvenen. VenaSeal® ist Therapie der 1. Wahl bei Stammvenen am Unterschenkel. Das VenaSeal® – System ist das teuerste endovenöse Verfahren an einer Stammvene, die immer mögliche simultane Therapie an mehreren Stammvenen senkt jedoch die Kosten auch im Vergleich zur klassischen radikalchirurgischen Therapie. Die Verschlussrate von VenaSeal® zu Radiofrequenztherapie ist gleich oder besser.
Die Qualitätsstandards für alle endovenösen Verfahren sind entwickelt und finden sich in den deutschen und internationalen Leitlinien. Wir haben sichere Kriterien für alle kathetergestützten Therapieverfahren. VenaSeal® arbeitet ohne mechanische oder thermische Energie, Nebenwirkungen radikaler Eingriffe oder von Laser oder Radiowelle sind hier kein Thema (Nervenschäden!). Der Schmerz-Index ist signifikant geringer (1,3 VenaSeal – 3,4 Radiofrequenz). Wir brauchen weder eine Allgemeinnarkose noch eine Tumeszenz-Anästhesie, auch nicht bei der simultanen Therapie von mehreren Stammvenen. Auch eine Kompressionstherapie mit Strumpf ist in der Regel nicht notwendig, wir setzen den Kompressionsstrumpf erst ab einem Venendurchmesser von mehr als 1,2 cm ein. Eine simultane Therapie von bis zu 6 Stammkrampfadern (2 Katheter) in einer Sitzung ist möglich.
Saphenion®: Side effects of vein glue – Our opinion:
VenaSeal® is one of the endovenous techniques with a high degree of effectiveness, and the quality standards are similar to those of other treatment options. The VenaSeal® vein glue is safe in the treatment of all truncal veins, lateral branches, and perforating veins up to a diameter of 1.5 – 2.0 cm. Larger diameters are possible but require a modified treatment regimen. We also recommend vein sealing for ectatic veins (over 1.5 cm), aneurysms, and post-inflammatory truncal veins. VenaSeal® is the treatment of choice for truncal veins in the lower leg. The VenaSeal® system is the most expensive endovenous procedure on a truncal vein, but the simultaneous treatment of several truncal veins, which is always possible, also reduces costs compared to classic radical surgery. The closure rate of VenaSeal® to radiofrequency therapy is the same or better.
The quality standards for all endovenous procedures have been developed and can be found in the German and international guidelines. We have safe criteria for all catheter-based therapy procedures. VenaSeal® works without mechanical or thermal energy; side effects of radical procedures or laser or radio waves are not an issue here (nerve damage!). The pain index is significantly lower (1.3 VenaSeal – 3.4 radiofrequency). We do not need general anesthesia or tumescent anesthesia, not even for the simultaneous treatment of several truncal veins. Even a simultaneous treatment of up to 6 truncal varicose veins (2 catheters) in one session is possible.


Saphenion®: Nebenwirkungen beim Venenkleber – Unser Resümee:
Nach 23 Jahren Arbeit mit endovenöser Technik: Unsere Erfahrungen mit der endovenösen Therapie und seit nahezu 13 Jahren speziell mit dem Kleber VenaSeal®, machen ihn zu unserer Basistherapie bei der Stammvaricosis. Der Venenkleber „VenaBlock® wird von uns nicht regelmäßig eingesetzt.
Die thermische Therapie ist nicht out, aber der Therapiepfad wird differenzierter, radikalchirurgische Therapieformen sind nur in speziellen Fällen und bei besonderer Venenanatomie zu diskutieren.
Saphenion®: Side effects of vein glue – Our summary:
After 23 years of working with endovenous technology, our experience with endovenous therapy and, in particular, with the VenaSeal® vein glue for nearly 13 years, makes it our basic therapy for truncal varicosis. We do not regularly use the vein glue VenaBlock®.
Thermal therapy is not out, but the therapy path is becoming more different, and radically surgical forms of therapy are only to be discussed in special cases and with special vein anatomy.
Photos Video: Utzius, Claudia
Literatur / Links:
Almeida JI, Murray SP, Romero ME. Saphenous vein histopathology 5.5 years after cyanoacrylate closure. J Vasc Surg Venous Lymphat Disord. 2019 Jul 4. PII: S2213-333X(19)30325-7. doi: 10.1016/j.jvsv.2019.04.014. [Epub ahead of print] PubMed PMID: 31281102.
Bahi M, Guazzo L, Taumoepeau L. Real-world short-term VenaSeal ablation outcomes for symptomatic saphenous incompetence. Vascular. 2023 Jun;31(3):521-525. doi: 10.1177/17085381221077511. Epub 2022 Feb 25. PMID: 35209758.
Chan YC, Law Y, Cheung GC, Ting AC, Cheng SW. Cyanoacrylate glue used to treat great saphenous reflux: Measures of the outcome. Phlebology. 2017 Mar;32(2):99-106. doi: 10.1177/0268355516638200. Epub 2016 Jul 9. PubMed PMID: 27052039.
Chan SSJ, Yap CJQ, Tan SG, Choke ETC, Chong TT, Tang TY. The utility of endovenous cyanoacrylate glue ablation for incompetent saphenous veins in the setting of venous leg ulcers. J Vasc Surg Venous Lymphat Disord. 2020 Mar 20. PII: S2213-333X(20)30100-1. doi: 10.1016/j.jvsv.2020.01.013. [Epub ahead of print] PubMed PMID: 32205130.
Cho S, Park HS, Lee T, Byun SJ, Yun WS, Yang SS, Kim H, Kim WS, Joh JH, Jung IM. CASS (CyanoAcrylate closure versus Surgical Stripping for incompetent saphenous veins) study a randomized controlled trial comparing clinical outcomes after cyanoacrylate closure and surgical stripping for the treatment of incompetent saphenous veins. Trials. 2020 Jun 3;21(1):460. doi: 10.1186/s13063-020-04393-0. PMID: 32493398; PMCID: PMC7268719.
Dinc R. VenaBlock® and VenaSeal® class III cyanoacrylate products are effective and safe in varicose vein treatment. Phlebology. 2024 May;39(4):284-285. doi: 10.1177/02683555231221319. Epub 2023 Dec 10. PMID: 38073234.
Fiengo L, Gwozdz A, Tincknell L, Harvey V, Watts T, Black S. VenaSeal closure despite the allergic reaction to n-butyl cyanoacrylate. J Vasc Surg Cases Innov Tech. 2020;6(2):269-271. Published 2020 Apr 10. doi:10.1016/j.jvscit.2020.03.011
Gibson K, Ferris B. Cyanoacrylate closure of incompetent great, small, and accessory saphenous veins without the use of post-procedure compression: Initial outcomes of a post-market evaluation of the VenaSeal System (the WAVES Study). Vascular. 2017 Apr;25(2):149-156. doi: 10.1177/1708538116651014. Epub 2016 Jul 9. PubMed PMID: 27206470.
Gibson K, Morrison N, Kolluri R, Vasquez M, Weiss R, Cher D, Madsen M, Jones A. Twenty-four-month results from a randomized trial of cyanoacrylate closure versus radiofrequency ablation for the treatment of incompetent great saphenous veins. J Vasc Surg Venous Lymphat Disord. 2018 Sep;6(5):606-613. doi: 10.1016/j.jvsv.2018.04.009. Epub 2018 Jun 15. PubMed PMID: 29914814.
Gibson K, Minjarez R, Rinehardt E, Ferris B. Frequency and severity of hypersensitivity reactions in patients after VenaSeal™ cyanoacrylate treatment of superficial venous insufficiency. Phlebology. 2020;35(5):337-344. doi:10.1177/0268355519878618
Hirsch, Tobias: Vortrag auf den 27. Bonner Venentagen am 30.4.- 01.05.2021.
Hirsch, Tobias: Nebenwirkungen nach nicht-thermischer endovenöser Therapie; vasomed 2021; 33(2): 46-47
Hirsch T. Non-thermal endovenous treatment: acrylate adhesion of varicose saphenous veins. Phlebologie 2017; 46: 143–147.
Jones AD, Boyle EM, Woltjer R, Jundt JP, Williams AN.J Vasc Surg Cases Innov Tech. 2019 Aug 7;5(3):372-374. doi: 10.1016/j.jvscit.2019.05.004. eCollection 2019 Sep.PMID: 31440717
Jones AD, Boyle EM, Woltjer R, Jundt JP, Williams AN. Persistent type IV hypersensitivity after cyanoacrylate closure of the great saphenous vein. J Vasc Surg Cases Innov Tech. 2019 Aug 7;5(3):372-374. doi: 10.1016/j.jvscit.2019.05.004. eCollection 2019 Sep. PubMed PMID: 31440717; PubMed Central PMCID: PMC6699189.
Kolluri R, Chung J, Kim S, Nath N, Bhalla BB, Jain T, Zygmunt J, Davies A. Network meta-analysis to compare VenaSeal with other superficial venous therapies for chronic venous insufficiency. J Vasc Surg Venous Lymphat Disord. 2020 Feb 13. PII: S2213-333X(19)30702-4. doi: 10.1016/j.jvsv.2019.12.061. [Epub ahead of print] Review. PubMed PMID: 32063522.
Lam YL, De Maeseneer M, Lawson J, De Borst GJ, Boersma D. Expert review on the VenaSeal® system for endovenous cyanoacrylate adhesive ablation of incompetent saphenous trunks in patients with varicose veins. Expert Rev Med Devices. 2017 Oct;14(10):755-762. doi: 10.1080/17434440.2017.1378093. Review. PubMed PMID: 28892412.
Lane TR, Kelleher D, Moore HM, Franklin IJ, Davies AH. Cyanoacrylate glue for the treatment of great saphenous vein incompetence in the anticoagulated patient. J Vasc Surg Venous Lymphat Disord. 2013 Jul;1(3):298-300. doi: 10.1016/j.jvsv.2012.09.007. Epub 2013 Feb 15. PubMed PMID: 26992590.
Morrison N, Gibson K, McEnroe S, Goldman M, King T, Weiss R, Cher D, Jones A. Randomized trial comparing cyanoacrylate embolization and radiofrequency ablation for incompetent great saphenous veins (venclose). J Vasc Surg. 2015 Apr;61(4):985-94. doi: 10.1016/j.jvs.2014.11.071. Epub 2015 Jan 31. PubMed PMID: 25650040.
Morrison N, Gibson K, Vasquez M, Weiss R, Jones A. Five-year extension study of patients from a randomized clinical trial (VeClose) comparing cyanoacrylate closure versus radiofrequency ablation for the treatment of incompetent great saphenous veins. J Vasc Surg Venous Lymphat Disord. 2020 Mar 20. PII: S2213-333X(20)30105-0. doi: 10.1016/j.jvsv.2019.12.080. [Epub ahead of print] PubMed PMID: 32205125.
Nasser H, Ivanics T, Shakaroun D, Lin J. Severe phlebitis-like abnormal reaction following great saphenous vein cyanoacrylate closure. J Vasc Surg Venous Lymphat Disord. 2019 Jul;7(4):578-582. doi: 10.1016/j.jvsv.2019.03.010. Epub 2019 May 8. PubMed PMID: 31078516.
Navarro-Triviño FJ, Cuenca-Manteca J, Ruiz-Villaverde R. Allergic contact dermatitis with systemic symptoms caused by VenaSeal. Contact Dermatitis. 2020 Mar;82(3):185-187. doi: 10.1111/cod.13431. Epub 2019 Nov 15. PubMed PMID: 31674037.
O’Banion LAA, Siada S, Cutler B, Kochubey M, Collins T, Ali A, Tenet M, Dirks R, Kiguchi MM. Thrombotic complications after radiofrequency and cyanoacrylate endovenous ablation: Outcomes of a multicenter real-world experience. J Vasc Surg Venous Lymphat Disord. 2022 Nov;10(6):1221-1228. doi: 10.1016/j.jvsv.2022.05.009. Epub 2022 Jul 16. PMID: 35843596.
Park I. Successful use of VenaSeal system for the treatment of large great saphenous vein of 2.84-3cm diameter. Ann Surg Treat Res. 2018 Apr;94(4):219-221. doi: 10.4174/astr.2018.94.4.219. Epub 2018 Mar 26. PubMed PMID: 29629358; PubMed Central PMCID: PMC5880981.
Park I. Initial Outcomes of Cyanoacrylate Closure, VenaSeal System, for the Treatment of the Incompetent Great and Small Saphenous Veins. Vasc Endovascular Surg. 2017 Nov;51(8):545-549. doi: 10.1177/1538574417729272. Epub 2017 Oct 2. PubMed PMID: 28969499.
Park I, Kim D. Correlation Between the Immediate Remnant Stump Length and Vein Diameter After Cyanoacrylate Closure Using the VenaSeal System During Treatment of an Incompetent Great Saphenous Vein. Vasc Endovascular Surg. 2019 Oct 3:1538574419879563. doi:10.1177/1538574419879563. [Epub ahead of print] PubMed PMID: 31581906.
Park I, Jeong MH, Park CJ, Park WI, Park DW, Joh JH. Clinical Features and Management of „Phlebitis-like Abnormal Reaction“ After Cyanoacrylate Closure for the Treatment of Incompetent Saphenous Veins. Ann Vasc Surg. 2019;55:239-245. doi:10.1016/j.avsg.2018.07.040
Tang TY, Tiwari A. The VenaSeal™ Abnormal Red Skin Reaction: Looks Like but is not Phlebitis!. Eur J Vasc Endovasc Surg. 2018;55(6):841. doi:10.1016/j.ejvs.2018.02.003
Shaĭdakov EV, Mel’tsova AZ, Porembskaia OI, Kudinova EA, Korzhevskiĭ DÉ, Kirik OV, Sukhorukova EG. [Experience with using cyanoacrylate glue in endovascular treatment of varicose veins]. Angiol Sosud Khir. 2017;23(4):62-67. Russian. PubMed PMID: 29240057.
Watts TJ, Thursfield D, Haque R. Allergic contact dermatitis caused by VenaSeal tissue adhesive. Contact Dermatitis. 2019 Jun;80(6):393-395. doi: 10.1111/cod 13206. Epub 2019 Jan 30. PubMed PMID: 30582174.
https://www.rdglobal.com.tr/product/Venablock-varicose-vein-device
Zierau UT and Lahl W: Recurrence Discussion in Varicose Veins Therapy – A Critical Examination of the Vein Stump discussion; J. Vasc. Endovasc. Therapy 2019, Vol 4 No.2:13
https://www.saphenion.de/news/saphenion-8-jahre-venenkleber
